


İlaçların güvenli bir şekilde kullanımlarının sağlanması amacıyla advers reaksiyonların ve yarar/risk dengelerinin sistematik bir şekilde izlenmesi, bu hususta bilgi toplanması, kayıt altına alınması, değerlendirilmesi, arşivlenmesi, taraflar arasında irtibat kurulması ve ilaçların yol açabileceği zararın en az düzeye indirilebilmesi için gerekli tedbirlerin alınması Kurumumuzda yürütülen farmakovijilans faaliyetlerinin temelini oluşturmaktadır. Bu amaçla yürütülen faaliyetler aşağıdaki gibi sıralanabilir:
-
2. HASTALAR İÇİN BİLGİLER
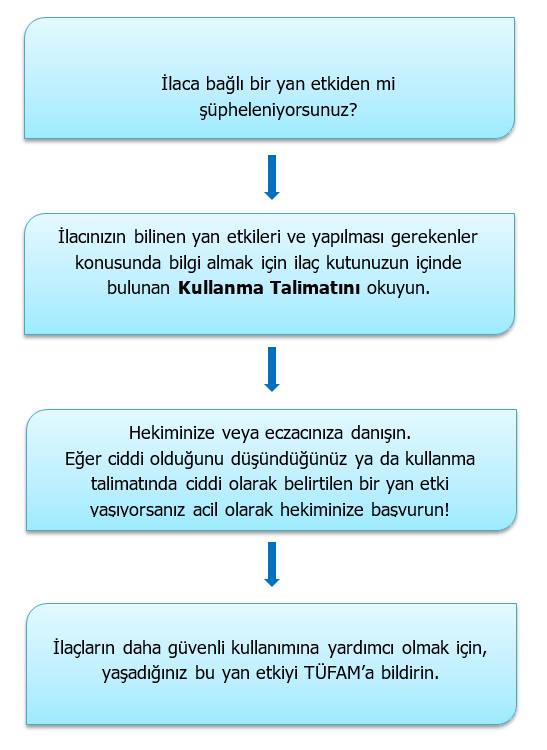
Beklenmeyen yani ilacınızın Kullanma Talimatında yer almayan yan etkilerin bildiriminin özellikle önemli olduğunu unutmayın!!!
İlaçların yan etkilerinin bildirilmesi neden gerekir?
Her ilacın istenmeyen bazı yan etkileri ortaya çıkabilir. Pek çok yan etki hafifken bazıları ciddi olabilir. İlaçlar ruhsat alıp piyasaya çıkmadan önce kapsamlı klinik araştırmalar ile test edilmektedir ancak ilacın yaygın olarak veya uzun süreli kullanımında ortaya çıkabilecek yan etkilerden bazıları henüz tespit edilmemiş olabilir. Bu nedenle karşılaştığınız ilaç yan etkilerini bildirmeniz daha önce bilinmeyen yan etkilerin ve ilaca bağlı problemlerin saptanmasında ve gerekli önlemlerin alınmasında büyük önem taşır.
Eğer bir ilacın yeni bir yan etkisi saptanırsa, Türkiye Farmakovijilans Merkezi (TÜFAM) bu ilacın güvenli bir şekilde kullanılabilmesi amacıyla, ilacı kullanan kişiler için riski en aza indirmek üzere önlemler alır.
Nasıl Bildirim Yapabilirim?
!Yan etki bildiriminiz sırasında herhangi bir tıbbi tavsiye verilememektedir. Lütfen doktorunuza ya da eczacınıza danışınız.
Yan etki bildirimi yapmak için ana sayfada bulunan “İlaç Yan Etki Bildirimi” bölümü tıklayarak elektronik bildirim yapabilirsiniz.
Ya da ücretsiz 0 800 314 00 08 numaralı hattı sabit hatlardan 09:00-18:00 saatleri arasında arayarak bildirim yapabilirsiniz.
Ya da “İlaç Yan Etki Bildirim Formu” nu doldurarak merkezimize posta, e-posta veya faks ile ulaştırabilirsiniz.
Yan etki bildirimi yaparken hangi bilgiler gereklidir?
3. FARMAKOVİJİLANS SÖZLÜĞÜ
Advers reaksiyon/şüpheli advers reaksiyon: Bir ilaca karşı gelişen zararlı ve amaçlanmayan cevap.
Beklenmeyen advers reaksiyon: İlaca ait kısa ürün bilgileri ile nitelik, şiddet veya sonlanım açısından uyumlu olmayan advers reaksiyon.
Ciddi advers reaksiyon: Ölüme, hayati tehlikeye, hastaneye yatmaya veya hastanede kalma süresinin uzamasına, kalıcı veya belirgin sakatlığa veya iş göremezliğe, doğumsal anomaliye veya doğumsal bir kusura neden olan advers reaksiyon.
Farmakovijilans: Advers reaksiyonların ve ilaçla ilgili diğer sorunların tespit edilmesi, değerlendirilmesi, anlaşılması ve önlenmesine yönelik yürütülen faaliyetler ve bilimsel çalışmalar.
Risk: Hasta sağlığı veya halk sağlığı yönünden ilacın kalitesi, güvenliliği ya da etkililiği ile ilgili ve ayrıca çevre açısından arzu edilmeyen her türlü risk.
Sağlık mesleği mensubu: Şüpheli advers reaksiyonların bildirilmesi bağlamında; hekim, eczacı, diş hekimi, hemşire ve ebeler.
Sinyal: Gözlemler ve deneyler de dahil olmak üzere bir veya birden fazla kaynaktan alınan, bir müdahale ile bir veya birden fazla olay arasında olumlu ya da olumsuz olası yeni bir nedensellik ilişkisi bulunduğunu ya da bilinen bir nedensellik ilişkisinin yeni bir boyut kazandığını düşündüren ve doğrulayıcı işlem gerektiren bilgiler.
TÜFAM: Türkiye Ilaç ve Tıbbi Cihaz Kurumu bünyesinde kurulmuş olan Türkiye Farmakovijilans Merkezi.
TÜFAM bildirim formu: Tek bir hastada belli bir zaman noktasında belli bir ilaca karşı gelişen bir veya birden fazla şüpheli advers reaksiyonu bildirirken kullanılan form.
Tüketici: Şüpheli advers reaksiyonların bildirilmesi bağlamında; hasta ya da bir hastanın avukatı, arkadaşı ya da akrabası/ebeveyni/çocuğu gibi sağlık mesleği mensubu olmayan kişiler.
Yarar/risk dengesi: Bir ilacın tedavi edici etkilerinin, ilacın hastaların sağlığı ya da halk sağlığı açısından oluşturduğu tüm kalite, güvenlilik ve etkililik riskleri ile birlikte değerlendirilmesi.
4. FARMAKOVİJİLANS İRTİBAT NOKTALARI VE İL SORUMLULARI İÇİN BİLGİLER
4.1. Farmakovijilans İrtibat Noktaları ve İl Sorumluları İçin Standart Çalışma Yöntemi
“İllerde Yürütülecek Farmakovijilans Faaliyetleri İçin Standart Çalışma Yöntemi Esasları”na ulaşmak için tıklayınız.
4.2. Farmakovijilans İrtibat Noktaları İçin Bilgiler
Farmakovijilans İrtibat Noktalarının (FİN) Görevlendirilmesi:
Tüm hastanelerin bir eczacı ya da hekimi (ağız diş sağlığı merkezlerinde diş hekimi de atanabilir) farmakovijilans irtibat noktası (FİN) olarak görevlendirmesi gerekmektedir. Görevlendirilen bu kişinin mesleki özgeçmişi ve iletişim bilgilerini de içeren görevlendirme yazısı hastanenin bulunduğu ilin İl Sağlık Müdürlüğüne gönderilecektir. FİN kayıtları il sağlık müdürlüklerince tutulacak olup, kayıtlı FİN listesi Kurumumuz internet sitesinde yayımlanacak ve aylık bazda güncellenecektir.
Farmakovijilans İrtibat Noktası Değişiklikleri:
Atanmış olan FİN' in görevinden ayrılması durumunda hastane yönetimi tarafından yeni bir FİN görevlendirilmelidir. Değişiklik olması halinde, İl Sağlık Müdürlüğüne eski FİN’in görevden ayrılma tarihi belirtilerek yeni FİN için yukarıda belirtildiği şekilde yeni bir görevlendirme yazısı gönderilmesi gerekmektedir.
Advers Reaksiyon Bildirimlerinin Gönderilmesi:
FİN’ler kendilerine ulaşan ya da kendilerinin tespit ettikleri advers ilaç reaksiyonlarını TÜFAM' a faks, e-posta ya da posta ile bildirebilirler (Bakınız; sağlık mesleği mensupları için bilgiler). Eğer FİN'ler kendilerinin tespit ettikleri advers ilaç reaksiyonunu bildiriyorlarsa, formdaki "Bildirim Yapan Kişiye Ait Bilgiler" bölümüne kendi bilgilerini yazmalıdır. Eğer kendilerine ulaşan bildirimleri TÜFAM'a iletiyorlarsa, "Bildirim Yapan Kişiye Ait Bilgiler" bölümü ilk raportöre ait bilgileri içermeli, FİN'ler formun altına paraflarını ekleyerek TÜFAM'a iletmelidir.
4.3. Farmakovijilans İrtibat Noktaları Listesi
İl sağlık müdürlüklerince EBS üzerinden kayıtları yapılan farmakovijilans irtibat noktaları listesine ulaşmak için tıklayınız (Son güncelleme tarihi: (06.03.2024) .
4.4. Farmakovijilans İl Sorumluları İçin Bilgiler
İl sağlık müdürlükleri tarafından ilgili başkan ya da başkan yardımcısının “farmakovijilans il sorumlusu” olarak görevlendirilmesi gerekmektedir. Görevlendirilen kişinin isim ve iletişim bilgileri Kuruma resmi yazı ile bildirilmelidir.
Farmakovijilans İrtibat Noktası Kayıtları:
Farmakovijilans İrtibat Noktası (FİN) kayıtları, Kurumumuz elektronik başvuru sistemi (EBS) üzerinden İl Sağlık Müdürlüklerince yapılacaktır. İl Sağlık Müdürlüğü yetkilisi, EBS’ ye kullanıcı girişi yaptıktan sonra sol kısımda yer alan “Farmakovijilans İşlemleri” altındaki “İrtibat Noktası Ekle” başlığı üzerinden kayıt işlemlerini gerçekleştirecektir.
Farmakovijilans İrtibat Noktası Değişiklikleri:
Mevcut FİN’in görevden ayrılması halinde, hastanelerin yeni bir görevlendirme yaparak İl Sağlık Müdürlüğüne başvurması gerekmektedir. FİN değişikliği olduğunda; İl Sağlık Müdürlüğü yetkilisinin öncelikle EBS üzerinden eski görevlendirmeyi sonlandırması gerekmektedir. Bunun için eski FİN kaydında görevden ayrılma tarihi kısmının doldurulması yeterlidir. Yeni görevlendirme eski kaydın üzerine yapılmayacak olup “İrtibat Noktası Ekle” başlığı üzerinden yeni bir kayıt oluşturulması gerekmektedir.
5. EĞİTİM VE TOPLANTILAR
5.1. Katkıda Bulunduğumuz Eğitim Ve Toplantılar
Eczacılık ve Tıp Fakülteleri Farmakovijilans Eğitimleri
Katılım Sağlanan Kongre ve Toplantılar
5.2. Verdiğimiz Eğitimler
Farmakovijilans İrtibat Noktaları ve Sağlık Mesleği Mensupları Eğitimleri
Farmakovijilans Yetkilisi Eğitimleri
|
KILAVUZ KODU |
İYİ
FARMAKOVİJİLANS UYGULAMALARI KILAVUZLARI |
İLK
YAYIN TARİHİ |
REVİZYON
TARİHİ |
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL I-
ADVERS İLAÇ REAKSİYONLARININ YÖNETİMİ VE BİLDİRİMİ |
12.06.2014 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL II- EK İZLEME |
15.07.2014 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL III-
PERİYODİK YARAR/RİSK DEĞERLENDİRME RAPORU |
26.09.2014 |
25.08.2022 |
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL IV-
FARMAKOVİJİLANS KALİTE SİSTEMİ |
31.10.2014 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL V-
FARMAKOVİJİLANS SİSTEM ANA DOSYASI |
16.02.2015 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL VI-
RİSK YÖNETİMİ SİSTEMLERİ |
24.06.2015 |
11.08.2022 |
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL VI- EK
1- COVİD-19 AŞILARININ RİSK YÖNETİMİ PLANLARI İÇİN TEMEL GEREKLİLİKLER |
23.03.2022 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL VII-
SİNYAL YÖNETİMİ |
20.12.2016 |
08.03.2023 |
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL VIII-
GÜVENLİLİK İLETİŞİMİ |
27.04.2022 |
|
|
|
FARMAKOVİJİLANS UYGULAMALARI (İFU) KILAVUZU MODÜL IX- RİSK MİNİMİZASYON TEDBİRLERİ ARAÇLARIN SEÇİMİ FVK-KLVZ-09 |
27.04.2022 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL IX- EK
1- EĞİTİM MATERYALLERİ |
27.04.2022 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL X-
PAZARLAMA ÖNCESİ YARAR/RİSK DEĞERLENDİRMESİ |
20.06.2022 |
|
|
|
İYİ FARMAKOVİJİLANS UYGULAMALARI (İFU) MODÜL XI- PAZARLAMA
SONRASI YARAR/RİSK DEĞERLENDİRMESİ |
20.06.2022 |
20.01.2023 |
|
| EK-I | EK-I TANIMLAR | 12.06.2014 | 03.08.2022 |
|
|
DİĞER KILAVUZ VE REHBERLER |
İLK YAYIN TARİHİ |
REVİZYON TARİHİ |
|
FARMAKOVİJİLANS FAALİYETLERİNDE KVKK |
01.08.2019 |
|
|
|
FARMAKOVİJİLANS FAALİYETLERİNDE KRİZ YÖNETİMİ
REHBERİ |
27.04.2022 |
|
|
|
FARMAKOVİJİLANS İNDİKATÖRLERİ REHBERİ |
23.08.2022 |
|
|
|
FARMAKOVİJİLANS FAALİYETLERİNDE GÜVEN UYGULAMALARI
REHBERİ |
08.09.2022 |
|
|
|
TİTCK FARMAKOVİJİLANS SİSTEMİ KILAVUZU |
30.11.2022 |
|
|
| FVK-KLVZ-17 | Sözleşmeli Farmakovijilans Hizmet Kuruluşları İle Ruhsat Sahiplerince Yürütülen Farmakovijilans Çalışmalarının Usul Ve Esasları Hakkında Kılavuz | 11.05.2023 | 24.01.2024 |
2-TÜFAM ve Uluslararası Kuruluşlar
12-Farmakovijilans Risk Yönetimi Birimi'ne Yapılacak Başvurularda Dikkat Edilmesi Gereken Hususlar
Uzaktan eğitim
sistemi 01.11.2019 tarihinden itibaren kapatılmıştır. Verimlilik yerinde
değerlendirme denetimlerinde farmakovijilans uzaktan eğitim katılım belgesi
sorgulanmayacaktır. İleri tarihlerde farmakovijilans irtibat noktalarına
yönelik bir eğitim programı planlandığında tarafınıza bilgi verilecektir.
1.1. ADVERS İLAÇ REAKSİYONLARI HAKKINDA GENEL BİLGİLER
Advers İlaç Reaksiyonu Nedir?
Advers reaksiyon bir ilaca karşı gelişen zararlı ve amaçlanmayan cevabı ifade eder. Bu tanıma, aşağıdakilerden kaynaklanan advers reaksiyonlar dahildir:
Advers İlaç Reaksiyonlarının Sınıflandırılması
Sınıflamada kullanılan harfler İngilizce tanımlarının baş harflerinden oluşmaktadır.
Tip A (augmented): Bu tip reaksiyonlar olağan dozunda kullanılan bir ilacın normal etkisinin artması olarak düşünülebilir. Bu sınıftaki advers etkiler ilacın farmakolojik etkisinden kaynaklanan ve genellikle doza bağlı olarak ortaya çıkan öngörülebilir advers etkilerdir. Advers etkilerin %80’nini oluşturur (örneğin opioidlere bağlı solunum depresyonu, warfarine bağlı kanama).
Tip B (bizarre): Bu tip reaksiyonlar farmakolojik olarak öngörülebilir değildir. Doza bağlı olmayan ve potansiyel olarak daha ciddi advers etkilerdir (örneğin penisiline bağlı anafilaksi, klozapine bağlı agranülositoz).
Tip C (chronic): Bu tip reaksiyonlar, toplumda sık görülen doğal hastalıkların bazı ilaçların uzun süre (aylar ve yıllarca) kullanılması sonucu ilaca maruz kalan popülasyonda sıklığının artması şeklinde ortaya çıkar (örneğin tolbutamide uzun süre maruz kalan diyabetli hastalarda kardiyovasküler hastalığa bağlı mortalite artması). Bu tip reaksiyonların ilaçla ilişkilerinin kanıtlanabilmesi zordur ve uygun yöntemlerle önemli ölçüde istatiksel analiz yapılmasını gerektirir. Bu nedenle C tipi reaksiyonlara “istatistiksel etkiler” adı da verilir.
Tip D (delayed): Bu tip reaksiyonlar ilacın kullanımının üzerinden belirli bir zaman geçtikten sonra ortaya çıkan advers etkilerdir. Gecikmiş olarak meydana gelmeleri nedeniyle teşhis edilebilmeleri güçtür (Örneğin: nörolepetiklerle görülen tardif diskinezi).
Tip E (end of use): Bu tip reaksiyonlar ilaç kullanımının sonlanması (ilacın çekilmesi) ile ilişkilidir (Örneğin: Benzodiazepinlerle görülen çekilme ve yoksunluk sendromu).
Tip F (failure): Bu tip reaksiyonlar tedavinin başarısızlığı ile ilgilidir.
Tip G (genetic/genomic): Bu tip reaksiyonlar ise genetik kökenli advers etkileri kapsamaktadır.
Bu sınıflamanın bazı kısıtlılıkları nedeniyle Aronson ve Ferner tarafından üç boyutlu yeni bir sınıflama önerilmiştir. DoTS (dozla ilişkililik[dose-relatedness], zamanla ilişkililik [time-relatedness] ve hastanın duyarlığı [susceptibility] )
1.2. NELERİ BİLDİRMELİYİM?
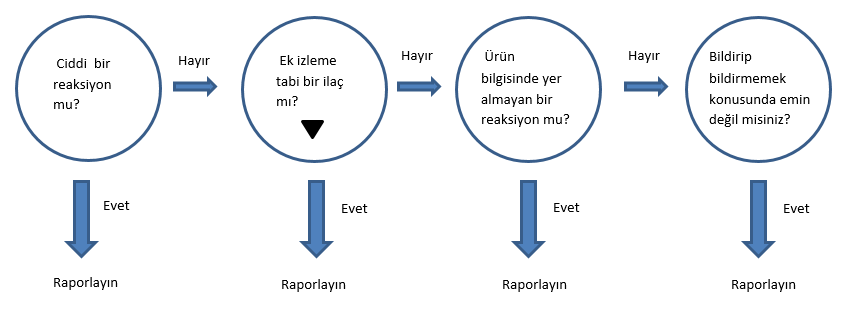
Advers reaksiyon raporlamak için ilacın advers reaksiyona sebep olduğundan emin olmanız gerekmez. Bir ilacın advers reaksiyona yol açtığından şüphelenmeniz bildirim yapmanız için yeterlidir. Hangi durumlarda raporlama yapmanız gerektiği ile ilgili detayları aşağıda bulabilirsiniz:
 amblemi taşıyan) ilaçlar ile ilgili tüm şüpheli advers reaksiyonlar
bildirilmelidir. Bu ilaçlar “ Ek İzlemeye Tabi İlaçlar Listesi” nde
duyurulmakta ve düzenli aralıklarla güncellenmektedir.
amblemi taşıyan) ilaçlar ile ilgili tüm şüpheli advers reaksiyonlar
bildirilmelidir. Bu ilaçlar “ Ek İzlemeye Tabi İlaçlar Listesi” nde
duyurulmakta ve düzenli aralıklarla güncellenmektedir.
Aşağıdaki durumlara sebebiyet veren reaksiyonlar ciddi advers reaksiyonlar olarak değerlendirilir:
Reaksiyonun ciddi olup olmadığına karar veremediğiniz durumlarda da bildirim yapınız!
Özel İlgi konusu diğer alanlar:
Çocuklarda ve yaşlılarda meydana gelen advers reaksiyonlar:
Yukarıda yer alan raporlama gereklilikleri bu grup için de geçerli olup, çocuk ve yaşlılar ile ilgili olarak yapılan bildirimler özel önem taşımaktadır. Çünkü;
Gebelik ve emzirme sırasında ilaç kullanımına bağlı ortaya çıkan advers reaksiyonlar:
Fetüs ya da çocukta meydana gelen konjenital anomaliler ya da büyüme geriliği ile ilgili raporların, fetüsün ölümü ya da spontan abortus raporlarının ve yenidoğanda meydana gelen ve ciddi şeklinde sınıflandırılan şüpheli advers reaksiyonlar ile ilgili raporların bildirimi önemlidir. Gebelik bildirimlerinde, gebelik boyunca alınan tüm ilaçların ve annenin son menstruasyon tarihini belirtmeyi lütfen unutmayınız.
Etkisizlik bildirimleri:
Özellikle hayati tehlike taşıyan hastalıkların tedavisinde kullanılan ilaçlar, aşılar ve kontraseptiflerde meydana gelen etkisizlik olaylarının bildirimi önem taşımaktadır.
Ciddi advers reaksiyonlara yol açan doz aşımı, endikasyon dışı kullanım, ilaç kullanım hatası ya da mesleki maruziyet raporları.
İlaç suiistimali ve kötüye kullanımı ile ilişkili bildirimler.
Biyolojik ilaçlar ve aşılar:
Biyolojik ilaçlar ve aşılarla ilgili bildirimlerde ilacın seri numarasının belirtilmesi önem taşımaktadır.
Gecikmiş ilaç etkileri:
İlaca maruziyetten aylar hatta yıllar sonra ortaya çıkabilecek advers reaksiyon bildirimleri ilaçların gecikmiş etkilerinin tespiti açıdan önem taşımaktadır. Örneğin; kanser, tardif diskinezi. Bu tip advers reaksiyonlar gecikmiş olarak meydana gelmeleri sebebiyle teşhis edilebilmeleri güçtür. Böyle bir ilişkiden şüphelenilmesi halinde mutlaka bildirim yapılmalıdır.
Bitkisel ürünler:
Geleneksel bitkisel tıbbi ürünler olarak kurumumuzca ruhsatlı ürünler dışında eczanelerde ya da çeşitli yollarla satılan pek çok bitkisel ürün bulunmaktadır. Kurumumuzca ruhsatlı olan ya da olmayan ürünlerle ilgili advers reaksiyonların bildirilmesi, bu tür ürünlerin güvenliliğinin tespiti açısından önem taşımaktadır.
Advers ilaç reaksiyonundan mı şüpheleniyorsunuz?
1.3. ADVERS İLAÇ REAKSİYONLARINI NASIL BİLDİREBİLİRİM?
Advers reaksiyon bildirim formunu bilgisayarınıza indirerek (indirmek için tıklayınız) formu doldurabilir ardından e-posta ile tufam@titck.gov.tr adresine iletebilirsiniz.
Ya da formun çıktısını alarak faks (+90 312 218 35 99) ya da posta ile formun altında bulunan adrese gönderebilirsiniz.
Ya da hastanede görev
yapıyorsanız hastanenizde bulunan farmakovijilans irtibat noktalarına (Listeye
4.3 no’lu başlıktan ulaşabilirsiniz.) bildirim yapabilirsiniz
Ya da ücretsiz 0 800 314 00 08 numaralı hattı sabit hatlardan
09:00-18:00 saatleri arasında arayarak bildirim yapabilirsiniz.
1.4. TÜFAM’A BİLDİRİLEN ADVERS REAKSİYONLAR NASIL DEĞERLENDİRİLİR?
Bildirimler TÜFAM’a ulaştıktan sonra vaka bir bütün olarak değerlendirilir. Eğer bildirimde eksiklikler varsa ya da vakayı değerlendirmek için ilave bilgiler gerekiyorsa bunlar saptanır ve bildirim yapan kişiye dönülerek eksiklikler tamamlanmaya çalışılır.
TÜFAM tarafından advers reaksiyon ile ilaç arasındaki ilişkinin derecesinin tespiti yani nedensellik değerlendirmesi yapılır. Bu değerlendirmenin yapılması sırasında göz önünde bulundurulan en önemli parametreler şunlardır:
Zamansal ilişki: İlaç kullanımı ve advers reaksiyonun ortaya çıkışı arasında geçen sürenin anlamlı olması ilaç ile advers reaksiyon arasındaki nedensellik ilişkisini kuvvetlendirir.
Advers reaksiyonun tipi ve doğası: Bazı advers reaksiyonlar ilacın farmakolojik etkilerinden kaynaklanan öngörülebilir ve doza bağlı advers reaksiyonlardır (örn: Beta blokerlere bağlı gelişen bradikardi, diüretiklere bağlı hipokalemi gibi). Bazıları ise öngörülemezler ve doza bağlı olarak ortaya çıkmazlar (örn: anaflaktik şok, Stevens-Johnson sendromu gibi).
Hastanın özellikleri ve ilgili tıbbi öykü: Hastanın tıbbi öyküsü, altta yatan hastalıkları (diyabet, hipertansiyon, böbrek yetmezliği vs), advers reaksiyonun ortaya çıkışında rol oynayabilir.
Birlikte kullanılan ilaçlar: Hastanın eş zamanlı olarak kullandığı başka ilaçlar varsa, ya da daha önce kullandığı ancak uzun bir yarı ömre sahip ilaç mevcutsa bunlar da değerlendirme esnasında göz önünde bulundurulmalıdır.
Laboratuvar bulguları: Vaka ile ilgili olduğu düşünülen laboratuvar bulgularının bilinmesi önemlidir. (örneğin advers reaksiyon olarak karaciğer enzimlerinin yüksekliği bildirilmişse hastanın ilaç kullanımından önceki ve sonraki karaciğer enzim test sonuçlarının varlığı ilaç ile advers reaksiyon arasındaki ilişkiyi gösteren önemli bir bulgudur)
Özgül tanı testleri:
Sataşmayı kaldırma (dechallenge): Bu terim advers reaksiyonun sebebi olduğundan şüphelenilen ilacın (şüpheli ilaç) kullanımının kesilmesini ifade eder. İlaç kullanımı kesildiğinde advers reaksiyonun ortadan kalkması, düzelmesi advers reaksiyon ile ilaç arasındaki ilişkiyi kuvvetlendirir.
Tekrar-sataşma (rechallenge): Şüpheli ilaç tekrar verildiğinde aynı advers reaksiyonun tekrar ortaya çıkması ilaç ile advers reaksiyon arasındaki ilişkinin (diğer faktörlerin de uygun olması halinde) kesin olduğunu gösterir.
İlaç etkileşmeleri: Şüpheli ilaç(lar) ve eş zamanlı olarak kullanılan ilaç(lar arasındaki muhtemel ilaç etkileşmeleri değerlendirilir.
Bildirimin kalitesi: Vakanın değerlendirilmesinde bildirimin kalitesi önemli bir parametredir. Formda yer alan bilgilerin tutarlılığı, bilgilerin doğru ve tam olarak forma aktarılması, yukarıda yer alan bilgilerin mümkün olduğunca tam olarak doldurulması sağlıklı bir nedensellik değerlendirmesi yapılmasını sağlar.
TÜFAM tarafından nedensellik değerlendirmesi yapılırken araştırılan bir diğer bilgi de daha önce aynı advers reaksiyonun dokümante edilip edilmediğidir. Öncelikle advers reaksiyonun ilacın kısa ürün bilgisinde yer alıp almadığına bakılır. İlacın kısa ürün bilgisinde yer almayan advers reaksiyonlar için öncelikle TÜFAM veri tabanı, Dünya Sağlık Örgütü veri tabanı ve ilaç bilgi kaynaklarında daha önce raporlanan benzer vakalar olup olmadığı kontrol edilir.
Tüm bu değerlendirmeler ışığında ilaç ile advers reaksiyon arasındaki nedensellik ilişkisinin derecelendirilmesi Dünya Sağlık Örgütü tarafından oluşturulan aşağıdaki tabloya göre yapılır:
Nedensellik değerlendirilmesinin ardından advers reaksiyon TÜFAM veri tabanına kaydedilir ve aynı zamanda Dünya Sağlık Örgütü İlaç İzleme İşbirliği Merkezi veri tabanına da gönderilir. Vakanın veri tabanına kaydı sırasında advers reaksiyonlar, ilaç endikasyonları ve laboratuvar bulguları dünya genelinde kullanılmakta olan bir sözlük (MedDRA) kullanılarak standart bir terminolojiye göre kodlanır. Standart terminoloji kullanımı veri analizi yapabilmek için gereklidir.
Dünya Sağlık Örgütüne kayıtlı tüm bu vakalar belirli periyodlarda incelenerek sinyal analizi yapılır. Bunun için çeşitli istatistiki yöntemler kullanılır.
Bir advers reaksiyonun sinyal olarak saptanmasında üç basamaklı bir süreç vardır. 1-hipotez üretme/oluşturma, 2-hipotezi güçlendirme ve eldeki verilerin ilk değerlendirmesi, 3-sinyali test etme, değerlendirme ve açıklama.
Ortaya çıkan sinyal sonucunda tavsiye edilen önlemlerin belirlenmesinde ilacın yarattığı risk yanında sağladığı yarar da hesaba katılarak yarar/risk analizi sonuçları, aynı endikasyonda mevcut alternatif tedaviler, ilacın kaldırılmasının hastaların prognozuna nasıl bir yansıma yapacağı gibi faktörler de dikkate alınır.
Sinyalin riski fazla bulunmamışsa önlem olarak dozlam değişikliği, veriliş yolu değişikliği, ilaç kutusuna veya kullanma talimatı/kısa ürün bilgisine uyarı konulması gibi önlemler alınabilir. Risk büyüdükçe farklı risk minimizasyonu faaliyetleri devreye girebilir ya da ilacın ruhsatının askıya alınması, iptal edilmesi ve piyasadan çekilmesi gerekebilir.